•JOHN DALTON, QUÍMICO Y FÍSICO BRITÁNICO.
• (1766-1844).
•CREÓ LA TEORÍA ATÓMICA.

MODELO DE DALTON
THOMSON
JOSEPH J. THOMSON MODIFICÓ EL TUBO DE RAYOS CATÓDICOS.

MODELO DE THOMSON
•MODELO DEL BUDÍN DE PASAS, TAMBÍEN CONOCIDO COMO PASTEL DE PASAS, EN DONDE LAS PASAS REPRESENTAN A LOS ELECTRÓNES.
 RUTHERFORD
RUTHERFORD
•ERNEST RUTHERFORD
•(1871-1937).
•DESCUBRIÓ LOS RAYOS ALFA, BETA Y GAMMA.

MODELO DE RUTHERFORD
•CONSIDERÓ AL ÁTOMO COMO UN SISTEMA PLANETRARIO, PERO SÓLO SE PODÍA REPRESENTAR UN SÓLO ELECTRÓN POR ORBITAL.

BOHR

•FÍSICO DANÉS
•NIELS BOHR.
•(1885-1962).
•EXPLICÓ LOS ESPECTROS ATÓMICOS COMO EL HIDRÓGENO.
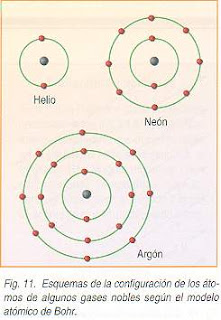
MODELO DE BOHR-SOMMERFELD
• PRIMER NIVEL 2 e
• SEGUNDO NIVEL 8 e
• TERCER NIVEL 18 e
• CUARTO NIVEL 32 e
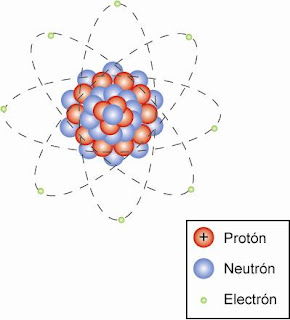
MODELO ACTUAL
ÁTOMO, PARTICULA DIMINUTA DE MATERIA E INDIVISIBLE.
NUMEROS CUÁNTICOS
•PRINCIPAL n, DETERMINA LA ENERGÍA DEL ELECTRÓN. ES UNA MEDIDA DEL TAMAÑO DEL ORBITAL Y PUEDE TOMAR VALORES DE n = 1,2,3…(n+1)
NUMEROS CUÁNTICOS
•SECUNDARIO O AZIMUTAL l, ESTÁ RELACIONADO CON LA FORMA DE LA ÓRBITA DONDE GIRA EL ELECTRÓN. SUS VALORES DEPENDEN DE n Y PUEDEN TOMAR VALORES DE 1 = 0,1,2,3…(n-1)
NUMEROS CUÁNTICOS
•MAGNÉTICO m, DETERMINA LA ORIENTACIÓN DE LA NUBE ELECTRÓNICA EN EL ESPACIO CUANDO SE SOMETE AL ÁTOMO A UN CAMPO MAGNÉTICO. PUEDE TOMAR VALORES DEPENDIENDO DE l QUE VAN DESDE -1 HASTA +1 PASANDO POR CERO, m = 2l +1.
NUMEROS CUÁNTICOS
•SPIN ms o s HACE REFERENCIA AL MOMENTO ANGULAR DE GIRO DEL ELECTRÓN, EL CUAL PUEDE SER EN EL SENTIDO DE LAS MANECILLAS DEL RELOJ O EN SENTIDO CONTRARIO Y PUEDE TOMAR VALORES DE + ½ O – 1/2 .
ORBITALES ATÓMICOS
ORBITALES s. LA FORMA DE ESTE ORBITAL ES ESFÉRICA Y SE PRESENTA CUANDO 1 = 0; SU TAMAÑO AUMENTA AL AUMENTAR EL NÚMERO CUÁNTICO n.
ORBITALES ATÓMICOS
ORBITALES p. TIENEN LA FORMA DE DOS LÓBULOS SITUADOS EN LADOS OPUESTOS AL NÚCLEO Y CON UN NODO, EL CUAL ES UN PLANO IMAGINARIO QUE DIVIDE AL NÚCLEO A LA MITAD. HAY TRES TIPOS DE ORBITALES p(1=1, m=-1, 0,1) QUE DIFIEREN EN SU ORIENTACIÓN.
ORBITALES ATÓMICOS
ORBITALES d. PRESENTAN LA FORMA DE LÓBULOS, PERO CON UNA DISTRIBUCIÓN MÁS COMPLEJA. EXISTEN CINCO TIPOS DE ORBITALES d(1=2, m=-2,-1,0,1,2) QUE SON dxy' dxz' dyz' dx2-y2' dz2' DE ACUERDO CON LOS CINCO VALORES POSIBLES DE m.
ORBITALES ATÓMICOS
ORBITALES f. SU ASPECTO ES MULTILOBULAR Y PRESENTA SIETE DIFERENTES ARREGLOS EN EL ESPACIO (1=3, m=-3,-2, -1, 0, 1, 2, 3) CON FORME A LOS SIETE VALORES POSIBLES DE m, SUS ARREGLOS SERÍAN fz3' fxz2' fyz2' fxyz' fz(x2-y2)' fx(x-3y2)' fy(3x2-y2)'
s-2 electrónes
p-6 electrónes
d-10 electrónes
f-14 electrónes
1s
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f
6s 6p 6d
7s 7p